Самоорганизация химических систем и энергетика химических процессов
Способность к взаимодействию различных химических реагентов определяется не только их атомарно-молекулярной структурой, но и условиями протекания химических реакций.
К условиям протекания химических процессов относятся: термодинамические факторы (температура, давление), наличие катализаторов и других добавок к реагентам, влияние растворителей, стенок реакторов и др. Указанные условия могут оказывать воздействие на характер и результат химических реакций при определенной структуре молекул химических соединений. Наиболее активны в этом отношении соединения переменного состава с ослабленными связями между их компонентами. Взять, например, реакцию синтеза из азота и водорода. Вначале его не удавалось получить ни с помощью большого давления, ни высокой температуры, и только использование в качестве катализатора специально обработанного железа впервые привело к успеху. В присутствии металлоорганического катализатора синтез аммиака происходит при обычной температуре (18 °С) и нормальном атмосферном давлении. Это открывает большие перспективы не только для производства удобрений, но в будущем такого изменения генной структуры злаков (ржи, пшеницы), когда они не будут нуждаться в азотных удобрениях.
Следует отметить, что возникновение и эволюция жизни на Земле были бы невозможны без существования ферментов
, служащих по сути дела живыми катализаторами. Однако, они функционируют только в рамках живой природы. Попытки перенести опыт живой природы на неорганический мир наталкиваются на серьезные ограничения.
Тот факт, что катализ играл решающую роль в процессе перехода от химических систем к биологическим, т.е. на предбиотической стадии эволюции, в настоящее время подтверждается многими данными и аргументами. Наиболее убедительные результаты связаны с опытами по самоорганизации химических систем, которые наблюдали наши ученые Борис Павлович Белоусов и Алексей Михайлович Жаботинский. Их трудами была открыта колебательная химическая реакция. Б.П. Белоусов сделал простой эксперимент. Он приготовил раствор, состоящий из лимонной кислоты (2,0 г.), серной кислоты (1:3) и 20 мл воды. Раствор периодически менял окраску: становился то желтым, то бесцветным. Впервые был открыт «химический маятник». Хотя на несколько лет это открытие было предано забвению, однако в 1970 г. А.М. Жаботинский повторил этот опыт и подтвердил открытие «химического маятника». Такие реакции сопровождаются образованием специфических пространственных и временных структур за счет поступления новых и удаления использованных химических реагентов. Однако в отличие от самоорганизации открытых физических систем в указанных химических реакциях важное значение приобретают каталитические процессы. Роль этих процессов усиливается по мере усложнения состава и структуры химических систем.
В настоящее время открыто более 50 автоволновых химических и биологических реакций, аналогичных реакции Белоусова – Жаботинского, часть из них – цветные
или флуоресцентные,что делает возможным непосредственное наблюдение и использование как аналоговых вычислительных устройств. На этом основании некоторые ученые связывают химическую эволюцию с самоорганизацией и саморазвитием каталитических систем. Однако, следует иметь ввиду, что переход к простейшим формам жизни возможен только при особом дифференциальном отборе таких химических элементов и их соединений, которые являются основным строительным материалом для образования биологических систем. В связи с этим достаточно отметить, что из более чем ста химических элементов лишь шесть (С, О2, Н2, S, СО, N), названных органогенами
, служат основой для построения живых систем.
Выдающимся достижением химии является открытие цепных реакций еще до того, как в физике был обнаружен радиоактивный распад.
Суть цепной реакции Н.Н. Семенов описывает так: «Энергии кванта достаточно для того, чтобы двухатомная молекула хлора распалась на отдельные атомы. Каждый из них активнее первоначальной молекулы и поэтому легко вступает в реакцию с молекулой водорода. Она также двухатомна (рис.).
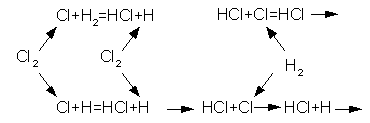
Схема цепной химической реакции
Один из атомов вместе с атомом хлора дает молекулу продукта-хлористого водорода, а другой атом водорода остается свободным. Теперь он легко вступает в реакцию с ближайшей молекулой хлора, образуя вторую молекулу хлористого водорода и отдельный атом хлора. Это повторяется много-много раз, возникает как бы длинная цепь реакций. Теория разветвленных цепных реакций дала начало новому направлению исследований – химической физике, дисциплине, промежуточной между физикой и химией.
