Строение родопсина
На молекулярном уровне белок опсин состоит из 348 аминокислотных остатков, образующий 7 гидрофобных зон, каждая из которых состоит из 20-25 аминокислот, составляя 7 трансмембранных спиралей. Ν-конец молекулы расположен во внеклеточном пространстве (т.е. внутри диска палочки), а С-конец находится в цитоплазме.

Рис.1. Структура родопсина позвоночных, встроенного в мембрану фоторецептора. Спираль несколько развернута, чтобы показать расположение ретиналя (указано черным). С - С-конец, N - N-конец.
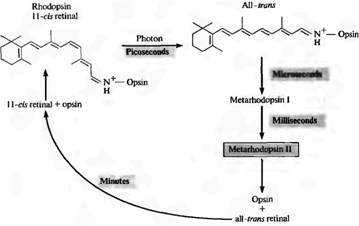
Рис.2. Выцветание родопсина на свету. В темноте 11-цис-ретиналь прочно связан с белком опсином. Захват фотона приводит к изомеризации all цис ре тиналя в троне ретиналь. При этом комплекс опсин all-тронс-ретиналь быстро превращается в метародо псин II, который диссоциирует на опсин и all троне ретиналь. Регенерация родопсина зависит от взаимодействия фоторецепторов и клеток пигментного зпителия. Метародопсин II включает и поддерживает в активном состоянии систему вторичных посредников.
Ретиналь соединен с опсином через остаток лизина, расположенный в седьмом трансмембранном сегменте. Опсин принадлежит к семейству белков, имеющих 7 трансмембранных доменов, в которое входят и метаботропные рецепторы медиаторов, такие как адренергические и мускариновые рецепторы. Как и родопсин, эти рецепторы передают сигнал ко вторичным посредникам посредством активации G-белка. Родопсин удивительно стоек в темноте. Байор подсчитал, что для спонтанной тепловой изомеризации молекулы родопсина необходимо около 3000 лет, или в 1023 больше, чем для фотоизомеризации.
